
保健原料/保健食品業者若有外銷美國的需求,對於新膳食成分 (New Dietary Ingredient, NDI) 及一般公認安全物質 (Generally Recognized as Safe, GRAS) 之規定想必一定不陌生,但是為了讓產品中的原料能夠合規上市並使用,相應的定義、規範及如何申請卻是對業者的一大挑戰,以下針對各規範進行說明、彙整,以及台美檢驗如何能協助您順利申請。
新膳食成分NDI
若預計在美國銷售的膳食補充品中含有新膳食成分,強制業者需要至少在上市前 75 天前向美國 FDA 提出通知,即新膳食成分通知 New Dietary Ingredient Notifications (NDIN);一般而言,膳食補充品意指產品中含有刻意讓消費者攝取補充營養的物質,包含以下「膳食成分」:
- 維生素
- 礦物質
- 草本植物及植物藥
- 胺基酸
- 供人體補充飲食食用,增加飲食總攝取量之物質,如:酵素、益生菌、器官組織等
- 含上述物質的濃縮物、代謝物、萃取物及複合物等
以上的「膳食成分」若於 1994 年 10 月 15 日前未於美國市場上市的成分,即被定義為「新膳食成分」。
新膳食成分通知檢附資料
如預計向 FDA 申請 NDIN,需蒐集及彙整以下資料,並使用 FDA電子入口網站 (CFSAN Online Submission Module, COSM) 進行送件。
- 申請者名稱與地址
- 新膳食成分名稱,如為草本植物或植物藥,需一併提供物種學名 (屬名+種名+作者名)
- 新膳食成分的論述及描述,包含:
- 新膳食成分在產品中的含量
- 標籤上指示的產品使用方式及條件,如未有規定,則說明一般普遍的使用方式
- 在建議及推薦的使用方式及條件下,新膳食成分的使用歷史、以及其他可佐證安全的資訊,並評估預期使用上為安全
- 評估人員、聯繫窗口或指定人員簽名
一般公認安全物質 GRAS
若有任何物質為了產生用途,而做為食品添加物被添加至食品中,必須於上市前先經過美國 FDA 的審查及核准,除非此物質為一般公認安全 (Generally Recognized as Safe, GRAS),或該物質為 1958 年前被認定為做為食品使用;依據美國 section 321 of the FD&C Act 針對食品添加物的定義為:「經合理預期具有用途可影響食品特性,直接或非直接的添加於食品中的物質」,但以下物質被排除在外:
- 殘留於原農產品或加工食品內,或其表面的農藥
- 化學農藥
- 著色劑
- 於 1958 年 9 月 6 日前經 Poultry Products Inspection Act 法令核准,或 1907 年 3 月 4 日前經 Meat Inspection Act 法令認可使用的物質
- 動物用新藥
- 膳食補充劑成分,或預期使用於膳食補充的成分
因此若有一新成分具有預期用途,並希望作為食品添加物使用的狀況下,除了需經由 FDA 正式審核之外,也可透過將新成分判定為 GRAS,兩者擇一進行;GRAS 屬於一種業者自主性的檢查,可以自行組成專家審查委員小組進行認定 (Self-affirmed GRAS),或備妥相關評估資料送至 FDA 進行 GRAS notice 審查,可能會取得 3 種回應:
- At the notifier’s request, FDA ceased to evaluate this notice (業者要求停止評估)
- Notice does not provide a basis for a GRAS determination (資料證據不足佐證為 GRAS)
- FDA has no questions (FDA 無意見)
一般而言透過 FDA 審查並取得「FDA has no questions」較具有公信力。
一般公認安全物質通知評估安全內容
依據 21 CFR 170.225~255及21 CFR 570.225~255 規範,提供給 FDA 的 GRAS Notice 評估資料需包含以下內容及評估結果:
- 申請人姓名及地址、申請物質的預期使用方式、目的、GRAS 自評摘要等資訊,以及需由申請人(或代理人)通知 FDA 進行 GRAS notice 的聲明及證明簽署 (Signed statements and a certification)
- 申請物質的資訊、製造方式、規格標準、化學特性…等,以及達到合理預期(物理及技術性質上)需求的添加量 (Identity, method of manufacture, specifications, and physical or technical effect.)
- 膳食暴露量 (Dietary exposure)
- 限制使用量自評 (Self-limiting levels of use)
- 1958 年之前的食用歷史佐證資料 (Experience based on common use in food before 1958.)
- 預期使用條件下的安全性論述 (Narrative)
- 佐證資料及文獻清單 (List of supporting data and information in your GRAS notice)
想進行美國NDI/GRAS notice? 台美檢驗可協助您:
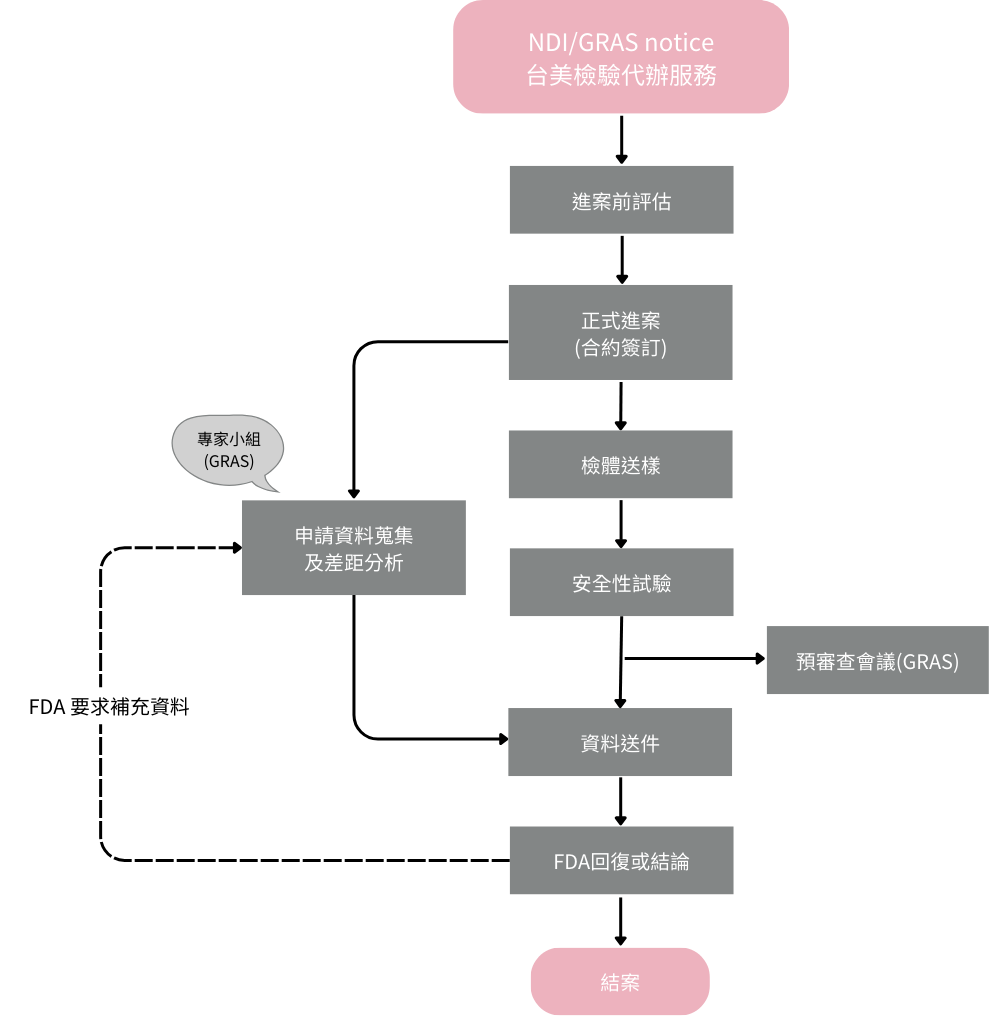
- 執行產品安全性毒理試驗設計、評估及執行
- GRAS專家小組組成
- 申請資料彙整及差距分析
- 美國FDA意見回復及資料彙整

你必須登入才能發表留言。